Вид документа: Приказ
Государственный информационно-правовой фонд: Государственный реестр нормативных правовых актов Донецкой Народной Республики , Нормативные правовые акты Донецкой Народной Республики
Наименование правотворческого органа: Министерство здравоохранения Донецкой Народной Республики
Дата документа: 04.08.2015
Номер документа: 012.1/244
Заголовок документа: Об утверждении Инструкций, регламентирующих деятельность учреждений службы крови
Действие документа: Действующий
Классификатор: 140.010.020 - Управление в сфере здравоохранения
Информация об опубликовании:
Официальный сайт Донецкой Народной Республики http://dnr-online.su/,
Дополнительные сведения:
Количество страниц:


Министерство здравоохранения
Донецкой Народной Республики
Приказ
(государственная регистрация отменена с 31.08.2020 – приказ Министерства юстиции ДНР от 31.08.2020 № 749-ОД)
С целью упорядочения регламентации производственной деятельности учреждений службы крови по заготовке, фракционированию донорской крови на ее компоненты, обеспечению контроля стерильности компонентов, а так же условий их заготовки, правильностью определения групповой и резусной принадлежности и переливания компонентов крови,
ПРИКАЗЫВАЮ:
1.1. Инструкцию по фракционированию донорской крови на ее компоненты: плазма, эритроциты, тромбоциты, лейкоциты (прилагается).
1.2. Инструкцию по донорскому плазмоферезу (прилагается).
1.3. Инструкцию по контролю стерильности консервированной крови, ее компонентов, препаратов, плазмозамещающих и консервирующих растворов, условий их заготовки (прилагается).
1.4. Инструкцию по определению групп крови по системе АВО, резус и иммунных антител (прилагается)
1.5. Инструкцию по переливанию крови и ее компонентов (прилагается).
2. Главным врачам республиканских, городских и районных лечебно-профилактических учреждений, станций переливания крови:
2.1. Обеспечить в подведомственных учреждениях внедрение и неуклонное четкое выполнение утвержденных инструкций.
3. Контроль за исполнением приказа возложить на директора департамента организации медицинской помощи населению Министерства здравоохранения Китик Л.И.
4. Контроль за исполнением данного приказа оставляю за собой.
5. Приказ вступает в силу со дня его официального опубликования.
Приказ Министерства здравоохранения
Донецкой Народной Республики
от 04.08.2015 №012.1/244
- Инструкция по фракционированию донорской крови на ее компоненты (плазма, эритроциты, тромбоциты, лейкоциты) и их консервирование
Общая часть
Фракционирование консервированной крови на компоненты и дифференцированное применение их в лечебной практике позволяет рационально использовать донорскую кровь в лечении больных. Основной клеточный компонент крови – эритроциты по физиологическим, функциональным и лечебным свойствами имеют преимущество над цельной консервированной кровью. Меньший объем эритроцитов вмещает значительно меньше цитрата, продуктов распада клеток, белковых антигенов и антител. Трансфузии эритроцитов занимают ведущее место в гемотерапии, направленной на восполнение дефицита красных клеток в случае острой и хронической анемий различной этиологии. Переливание концентратов тромбоцитов и лейкоцитов является средством терапии тяжелых заболеваний, которые сопровождаются дефицитом этих клеток .Оптимальное и рациональное фракционирование донорской крови на компоненты предусматривает их выделение в максимально возможном количестве и сохранение в функционально полноценном состоянии в течение определенного периода каждый компонент. С помощью фракционирования из дозы консервированной крови — 500 мл, может быть получено около 250 мл нативной плазмы и 250 мл эритроцитов, от 0,65 х 1011/л до 0,9 х 1011/л (в среднем 0,7 х 1011/л) тромбоцитов и от 0,8 х 109/л до 1,3 х 109/л (в среднем 1,1 х 109/л)) лейкоцитов.
1. Требования, предъявляемые к консервированной крови, предназначенной для фракционирования на компоненты
Консервированную донорскую кровь заготавливают в соответствии с действующим законодательством Донецкой Народной Республики.
1.1. При обследовании доноров, кровь которых предназначена для получения концентрата тромбоцитов, особое внимание необходимо обратить на отсутствие у них признаков кровоточивости (петехий, кровоподтеков и т.п.) и исключение приема ими аспирина в течение суток до кроведачи.
1.2. Донорскую кровь заготавливают в полимерные контейнеры на одном из консервантов, применяемых в службе крови.
1.3. Консервированную кровь, которая предназначена для фракционирования, хранят в холодильниках при температуре +4 +6º С (для последующего выделения плазмы, эритроцитов) или при температуре +22 ± 2º C (для выделения тромбоцитов и лейкоцитов) не более 1 суток с момента заготовки крови.
1.4. Консервированная кровь, предназначенная для фракционирования на компоненты, должна отвечать следующим требованиям:
— время хранения крови, предназначенной для выделения тромбоцитов и лейкоцитов, должно быть ограничено 4 — 6 часами после заготовки от донора, для получения эритроцитов — до 7 суток;
— для изготовления антигемофильной плазмы или криопреципитата рекомендуется использовать плазму, полученную в стационарных условиях не позднее 2 часов от момента заготовки крови, а при условии использования плазмы, полученной из крови, заготовленной в выездных условиях — от 4 до 6часов с момента заготовки.
— консервированная кровь, которая хранилась, должна иметь четко выраженную границу раздела между плазмой и клетками крови;
— плазма крови должна быть прозрачной, соломенно-желтого цвета, без мути, хлопьев, прожилок фибрина и признаков гемолиза, глобулярный слой крови должен быть равномерным, без неровностей.
1.5. Фракционирование крови, заготовленной в полимерные контейнеры, может проводиться в небоксированном помещении с соблюдением правил асептики.
2. Фракционирование консервированной крови для заготовки эритроцитов и плазмы
Для получения эритроцитов применяют методы спонтанного оседания (седиментации) эритроцитов или центрифугирование крови.
2.1. Заготовка эритроцитов и плазмы методом спонтанной седиментации крови в полимерных контейнерах
2.1.1. Контейнеры с кровью хранят в холодильнике при температуре +4 + 6º C.
2.1.2. Для заготовки плазмы и эритроцитов полимерный контейнер с осевшими форменными элементами крови осторожно помещают в плазмаэкстрактор этикеткой к задней его пластине, прижимая передней подвижной пластиной, снимают зажим с трубки, который ведет к спаренному пустому контейнеру и переводят в него плазму. Когда граница раздела плазмы и клеток крови оказывается возле входного отверстия главного контейнера, на трубку накладывают зажим на расстоянии 2 — 5 см от контейнера с плазмой. При отсутствии плазмаэкстрактора полимерный контейнер с кровью подвешивают на штативе, пустой контейнер размещают на столе. Ослабив зажим на соединительной трубке, осторожно сжимают рукой нижнюю часть контейнера с кровью и переводят плазму в пустой контейнер. Накладывают зажим на соединительную трубку на расстоянии 2 — 5 см от контейнера с кровью. Контейнеры, содержащие плазму и эритроциты герметизируют с помощью устройства для запаивания ПВХ трубок или другими способами (накладывают металлические кольца, завязывают два тугих узла).
2.1.3. Трубку между участками герметизации разрезают. Контейнер с плазмой отсоединяют, этикируют, замораживают и хранят в холодильной камере, при соответствующей температуре в зависимости от дальнейшего использования.
2.1.4. Контейнер с эритроцитами этикируют и хранят в холодильнике при температуре +4+6ºС ( длительность хранения эритроцитов определяется видом консерванта).
2.2. Заготовка эритроцитов и плазмы методом центрифугирования в полимерные контейнеры.
2.2.1. Проверяют герметичность полимерных контейнеров и соединительных трубок между главным и спаренными контейнерами.
2.2.2. Кровь тщательно перемешивают для равномерного распределения клеток крови в контейнере.
2.2.3. Контейнеры с кровью помещают в центрифужные стаканы, уравновешивают и центрифугируют при центробежном ускорении 1250g в течение 20 минут при температуре +4+6ºС (приложение № 1).
2.2.4. Дальнейшее выделение плазмы и эритроцитов, их герметизация, паспортизация проводится согласно п.2.1.2.-2.1.4.
3. Заготовка эритроцитов обедненных лейкоцитами и тромбоцитами (ЭОЛТ)
Трансфузии эритроцитов, обедненных лейкоцитами и тромбоцитами (ЭОЛТ), показаны сенсибилизированным больным, которые имеют лейкоцитарные, тромбоцитарные антитела, с целью предупреждения негемолитических посттрансфузионных реакций. Получение ЭОЛТ проводится методом центрифугирования и отмывания эритроцитов.
Отмывающим раствором является стерильный апирогенный 0,9% раствор натрия хлорида.
Заготовку вышеупомянутых компонентов крови осуществляют согласно поданным заявкам лечебных учреждений.
3.1. Получение ЭОЛТ из консервированной крови, заготовленной в полимерные контейнеры.
3.1.1. Для получения ЭОЛТ может быть использована кровь сразу же после заготовки, (параллельно с выделением концентратов тромбоцитов КТ, концентратов лейкоцитов КЛ и плазмы) или кровь от 2 — 7 суток хранения при температуре +4+6º C.
3.1.2. Контейнеры с консервированной кровью, предназначенной для получения ЭОЛТ, после тщательного перемешивания помещают в центрифужные стаканы, уравновешивают и центрифугируют при центробежном ускорении 2000 g в течение 5мин. (см. приложение 1).
3.1.3. После остановки центрифуги спаренный контейнер с кровью осторожно извлекают из центрифуги и помещают в плазмаэкстрактор, этикеткой повернутой к задней пластине.
3.1.4. Передней подвижной пластиной плазмаэкстрактора нажимают на контейнер с кровью. Ослабляют зажим на соединительной трубке между основным и спаренным пустым контейнерами и переводят плазму в пустой контейнер. Когда над эритроцитами остается слой плазмы высотой 2 — 3 см, (объемом около 40 — 50 мл), на соединительную трубку накладывают зажим на расстоянии 2 — 5 см от основного контейнера.
3.1.5. Плазму, оставшуюся в основном контейнере вместе со слоем эритроцитов высотой 1 — 2 см (общим объемом 30 — 40 мл) переводят во второй пустой дополнительный или присоединенный контейнер.
3.1.6. На соединительную трубку на расстоянии 2 — 5 см от основного контейнера и на таком же расстоянии от спаренного контейнера накладывают зажим герметизируют и разъединяют контейнеры с эритроцитами, плазмой, лейкотромбомассой и лейкоцитами.
3.1.7. Контейнер с плазмой направляют для замораживания или приготовления препаратов плазмы.
3.1.8. Контейнер с лейкотромбомассой направляют на повторное центрифугирование с целью получения КТ и КЛ или утилизируют.
3.1.9. К эритроцитам, что остались в основном контейнере, с помощью одноразовой инфузионной системы, добавляют стерильный 0,9% раствор натрия хлорида в объеме удаленной плазмы и тщательно перемешивают. Трубку, что идет к контейнеру, герметизируют путем завязывания двух тугих узлов или запаивают. Контейнер помещают в центрифужный стакан, уравновешивают и центрифугируют при центробежном ускорении 2000 g в течение 5 мин. при температуре +5±2º C ( приложение 1).
3.1.10. После центрифугирования контейнер осторожно переносят в бокс. Конец трубки обрабатывают 5% раствором йода и 96% этиловым спиртом, отсекают герметизирующие узлы, трубку контейнера соединяют стерильно с системой флакона, что остался после отмывающего раствора. С помощью плазмаэкстрактора в этот флакон перемещают надосадочную жидкость вместе со слоем лейкоцитов и эритроцитов высотой (0,5 ±0,2) см (10 — 15 мл). Не нарушая принцип закрытой системы отмывания, присоединяют другой флакон с 0,9% раствором натрия хлорида. Процедуру отмывания повторяют еще дважды, по п.3.1.9.
3.1.11. Отмытые эритроциты паспортизуют и выдают в лечебное учреждение для гемотрансфузии. Срок хранения отмытых эритроцитов 24 часа с момента приготовления. Хранение проводят в холодильнике при температуре +4+6ºС.
3.2. Заготовка ЭОЛТ из эритроцитов.
3.2.1. Заготовленные эритроциты хранят в холодильнике при температуре +4+6ºC от 2 до 7 суток.
3.2.2. Для приготовления ЭОЛТ используют методику описанную в п.3.1.9.-3.1.10.
3.2.3. Этикирование, хранение проводят согласно п. 2.1.2.-2.1.4.
4. Фракционирование консервированной крови для получения концентрата тромбоцитов (КТ)
Заготовленную в пластиковый контейнер консервированную кровь, предназначенную для выделения КТ, хранят при комнатной температуре +22±2ºC не дольше 4 — 6 часов с момента заготовки.
4.1. Перед центрифугированием проверяют герметичность контейнера с кровью, а также целостность соединительных трубок между главным и дополнительными контейнерами емкостью300/300мл.
4.2. Кровь в контейнерах тщательно перемешивают, уравновешивают, помещают в центрифужные стаканы, центрифугируют при центробежном ускорении 680 g в течение 13 мин (приложение 1), при температуре +22±ºC. Плазму, обогащенную тромбоцитами (ПОТ), переводят с помощью плазмаэкстрактора в спаренный контейнер без консерванта.
4.3. Контейнер с эритроцитами отсоединяют от спаренного контейнера с плазмой, этикируют и помещают в холодильник при температуре +4+6º C. Срок хранения эритроцитов для переливания — 21 -35дней (в зависимости от вида консерванта). Контейнеры с ПОТ центрифугируют при центробежном ускорении 2400 g в течение 20 мин. при температуре (4 +- 2) град. C (см. приложение 1). При таком режиме тромбоциты оседают на дно контейнера, а над ними располагается обедненная клетками плазма.
4.4. После остановки центрифуги контейнеры осторожно извлекают из центрифужных стаканов и помещают между пластинами плазмаэстрактора или подвешивают на штатив в вертикальном положении; дополнительный пустой контейнер располагают на столе.
4.5. Открывают зажим на соединительной трубке между контейнерами. Давлением пластины плазмаэкстрактора на контейнер большую часть плазмы переводят в пустой контейнер. Когда над тромбоцитами остается 50 — 60 мл плазмы, соединительную трубку перекрывают зажимом на расстоянии 2 — 5 см от контейнера с концентратом тромбоцитов (КТ).
4.6. Контейнер с КТ, вынимают из плазмаэкстрактора и, ослабляя зажим на трубке, выдавливают воздух из него в соединительную трубку или контейнер с плазмой (наличие воздуха в контейнере с КТ может привести к их агрегации). Контейнеры герметизируют.
4.7. Контейнер с плазмой после этикирования хранят и используют по назначению (п.2.1.3).
4.8. Контейнер с КТ оставляют без смешивания в спокойном состоянии на 1 час при температуре +22±2ºC. В таком состоянии происходит спонтанная дезагрегация тромбоцитов. Попытка ресуспендировать тромбоциты сразу же после отделения плазмы может привести к необратимой агрегации клеток, вследствие чего тромбоконцентрат окажется непригодным для переливания.
4.9. Через 1 час тромбоциты ресуспендируют осторожным размешиванием в плазме до гомогенной взвеси (не менее 20 минут).
4.10. Контейнер с КТ этикируют (на этикетке указывают название учреждения-заготовителя, объем и количество тромбоцитов (не менее 0,5 х 109/л), дату и время их заготовки, срок хранения, группу крови и резус-фактор донора, регистрационный номер, дату заготовки крови). Для определения объема КТ от веса контейнера с клетками вычитают массу пустого контейнера, равную (23,0 ± 1,0) г.
5. Фракционирование консервированной крови для получения концентрата лейкоцитов (КЛ)
5.1. Кровь заготавливают в полимерные контейнеры.
5.2. Контейнеры с консервированной кровью, после проверки на герметичность и тщательного перемешивания, помещают в центрифужные стаканы, центрифугируют при центробежном ускорении 2150 g в течение 20 мин. при температуре (22 ± 2) град. C (см. приложение 1). При таком режиме эритроциты оседают на дно контейнера, над ними располагается лейкоцитарно-тромбоцитарный слой (ЛТС) серо-розового цвета, сверху которого находится обедненная клетками плазма.
5.3. Основной контейнер с кровью, соединенный с пустыми контейнерами, осторожно извлекают из центрифужного стакана, не нарушая границу между слоями, и помещают в плазмаэекстрактор этикеткой к его задней пластине.
5.4. Переводят плазму сразу в спаренный контейнер, который после наполнения плазмой герметизируют, этикируют и отделяют от основного контейнера. Для выделения ЛТС, на соединительной трубке между основным и первым пустым контейнерами, ослабляют зажим и переводят ЛТС вместе с плазмой, что осталась над слоем эритроцитов объемом 50,0 ±5,0 мл, в пустой контейнер. Объем переведенной плазмы, лейкоцитов, тромбоцитов составляет примерно 110- 120 мл. На соединительную трубку на расстоянии 3 — 5 см от основного контейнера и на таком же расстоянии от контейнера с ЛТС накладывают зажим. Основной контейнер, в котором содержится концентрат эритроцитов (с гематокритным числом 0,80 — 0,90 л/л), отсоединяют и герметизируют, этикируют и хранят согласно п.2.1.4.
5.5. Контейнер, который содержит ЛТС с плазмой и эритроцитами, помещают в центрифужный стакан в вертикальном положении, уравновешивают и центрифугируют при центробежном ускорении 190 g в течение 10 мин. при температуре (+22 ± 2ºC). В центрифужные стаканы вкладывают твердые пластины-вкладыши, которые сдавливают контейнеры по бокам, для обеспечения постоянной толщины слоя по всей высоте во время центрифугирования и фиксируют их резиновыми кольцами. При таком режиме эритроциты и лейкоциты оседают на дно контейнера, а концентрированные тромбоциты в состоянии взвеси в плазме располагаются над ними.
5.6. После остановки центрифуги контейнер осторожно извлекают и помещают в плазмаэкстрактор в вертикальном положении, присоединяют к нему контейнер 300/300мл без консерванта, который располагают ниже уровня стола. Ослабляют зажим на соединительной трубке, перемещают КТ в контейнер 300/300. Когда у выходного отверстия трубки контейнера появится слой лейкоцитов, накладывают зажимы на расстоянии 2 — 5 см от контейнера. Проводят герметизацию обоих контейнеров и разъединяют их.
5.7. Контейнер, содержащий концентрат лейкоцитов (КЛ) отсоединяют. На этикетке указывают название учреждения-заготовителя и количество лейкоцитов (не менее 0,8 х 109/л), дату его заготовки, срок хранения, группу крови и резус-фактор донора, регистрационный номер, дату заготовки крови.
5.8.Контейнер, содержащий концентрат тромбоцитов (КТ), этикируют согласно п. 4.10.
6. Оценка качества компонентов крови
6.1. Перед тем, как выдать компоненты крови для трансфузии, проводят оценку их качества. Критериями пригодности для плазмы, во время визуального осмотра является: прозрачность плазмы (отсутствие мути, хлопьев, прожилок фибрина), для эритроцитов и ЭОЛТ – прозрачность надстоя, равномерность эритроцитного слоя, отсутствие видимых сгустков; для концентрата тромбоцитов (КТ) и концентрата лейкоцитов (КЛ) – гомогенность взвеси клеток и отсутствие агрегатов; для всех компонентов крови: целостность и герметичность полимерных контейнеров, наличие оформленных этикеток с указанием срока годности.
6.2. Правила и условия хранения компонентов крови.
6.2.1 Хранение КТ, полученного из свежезаготовленной донорской крови в полимерных контейнерах, проводят при комнатной температуре +22 ± 2ºC в течение 24 ч или при условии постоянного перемешивания на автоматических мешалках в течение 72 ч при той же температуре. Возможно также хранение КТ в течение 24 ч в холодильнике при температуре 4 ±2ºC, особенно в тех случаях, когда условия не дают возможности обеспечить режим комнатной температуры. Вынутый из холодильника полимерный контейнер с КТ может содержать видимые агрегаты тромбоцитов, которые исчезают при температуре +22 ± 2ºC течение 1 ч в покое и при дальнейшем осторожном перемешивании. В КТ, полученном из дозы консервированной крови, должно быть не менее 0,5 х 1011/л тромбоцитов в объеме плазмы не более 75 мл.
6.2.2. Хранение КЛ проводят при температуре +22 ± 2ºC или в условиях холодильника при температуре 4 ±2ºC в течение 24 ч. В КЛ должно быть не менее 0,8 х 109/л клеток в объеме плазмы не более 75 мл. Объем концентрата клеток определяют взвешиванием контейнера с КТ и КЛ, из массы которого вычитают вес пустого контейнера, что составляет в среднем 23 ±1 г.
6.2.3. Эритроциты, эритроцитную взвесь хранят при температуре +4 + 6ºC в холодильнике в течение срока, определенного рецептурой консерванта и ресуспендирующего растворов для крови и эритроцитов. Срок хранения ЭОЛТ — 24 часа при температуре+ 4 + 6ºC.
6.2.4. Свежезамороженную плазму хранят при температуре от минус 18 до минус 30ºC в течение 3 месяцев с момента заготовки, при температуре минус 30ºС и ниже на протяжении 36 месяцев.
7. Подготовка компонентов крови к трансфузии
Перед проведением трансфузии компонентов крови врач обязан проверить герметичность контейнеров и провести макроскопию (визуальную оценку) КТ, КЛ и эритроцитов. Трансфузию необходимо проводить, учитывая групповую и резус-принадлежность донора и больного, согласно Инструкции по переливанию крови и ее компонентов. При трансфузии КЛ необходимо учитывать антигенную совместимость донора и больного по системе HLA.
Концентраты тромбоцитов и лейкоцитов необходимо использовать в оптимальный срок — в день заготовки. Таким образом, обеспечивается функциональная полноценность клеток и максимальная лечебная эффективность.
Режимы центрифугирования консервированной крови для получения компонентов крови
Этапы работы Марки центрифуг РС-6 МРW 1. Центрифугирование крови на эритроциты и плазму (жесткое) 2000g
(2600 об/мин)
20 мин, t+5ºС2000g
(2600 об/мин)
20 мин, t+5ºС2. Центрифугирование крови на эритроциты и плазму 1250 g
(2000 об/мин)
20 мин, t+5ºС1250 g
(2000 об/мин)
20мин, t+5ºС3. Отмывание эритроцитов 2000g
(2500 об/мин)
5 мин, t+5ºС2000g
(2600 об/мин)
5 мин, t+5ºС4. Получение ТК
I – этапII – этап680g
(1500 об/мин)
13 мин
2400g
(3000 об/мин)
20 мин680g
(1600 об/мин)
13 мин
2400g
(3000 об/мин)
20 мин5. Получение ЛК
I- этапII — этап2150g
2800 об/мин
20 мин
190g
800 об/мин
10 мин2150g
2700 об/мин
20 мин
190g
800 об/мин
10 мин
- Инструкция по проведению донорского плазмафереза
Общая часть
Современным эффективным методом заготовки плазмы крови от доноров является плазмаферез. Он предусматривает получения от донора только плазмы с возвратом (реинфузией) собственных форменных элементов. Преимуществом плазмафереза является получение за один сеанс от одного донора значительно большее количество плазмы, чем при обычном взятии крови. Правильное проведение процедуры плазмафереза не вредит здоровью донора. Каждый сеанс плазмафереза контролирует врач, а донор заблаговременно должен быть ознакомлен с особенностями этой процедуры.
В зависимости от частоты получения плазмы, ее объема, а также времени восстановления концентрации белков крови донора, плазмаферез имеет три ступени интенсивности. Первая ступень интенсивности — однократный плазмаферез, предусматривает проведение плазмафереза 1-2 раза в год. Максимальная разовая доза сданной плазмы- не больше 600-800мл в зависимости от массы тела донора. Вторая ступень интенсивности — многократный плазмаферез – это 1-2 процедуры, при объеме изъятой плазмы 10-15 л в год и третья ступень — при которой плазмаферез проводят 1 раз в неделю, объем удаленной плазмы не должен превышать 12 л в год.
В зависимости от способа проведения, донорский плазмаферез делится на ручной (мануальный) и аппаратный (автоматизированный). При ручном плазмаферезе кровь забирают в пластикатный контейнер и центрифугируют. Его можно проводить однократно и двукратно. Применение двукратного плазмафереза позволяет в течение одной операции получать от специально отобранных доноров вдвое больше плазмы, чем при однократном. Восстановление белков плазмы при этом проходит достаточно быстро, как правило, в течение нескольких дней.
При аппаратном плазмаферезе кровь непрерывным потоком поступает в фракционатор где разделяется на компоненты. Плазму отбирают, а концентрат эритроцитов реинфузируют. При его проведении применяются специальные системы, которые позволяют хранить весь экскорпоральний контур полностью закрытым в течение всей процедуры. Эти системы имеют многозначные индивидуальные номера, по которым можно идентифицировать донора и его форменные элементы.
Получение плазмы методом плазмафереза позволяет получить свежезамороженную плазму, а также плазму, пригодную для изготовления антигемофильных препаратов, гамма-глобулинов, тромбина, альбумина и т.д. Для получения плазмы с высокой концентрацией специфических антител, плазмаферез проводят у доноров, которым проведена соответствующая иммунизация или у реконвалесцентов, перенесших соответствующие инфекционные заболевания с высоким содержанием в плазме иммунных антител.
1. Подбор и обследование доноров
К однократному плазмаферезу допускаются доноры, которые прошли медицинский осмотр в установленном порядке.
1.1 При подборе доноров к многократному плазмаферезу (с интервалом 7-14 суток) учитывают требования настоящей Инструкции и обязательно перед каждой плазмодачей проводят:
а) определение уровня гемоглобина (для мужчин — в пределах 130-160 г/л, для женщин — 120-140 г/л);
б) определение показателя гематокрита (0,40-0,48л/л);
в) определение общего количества белка крови методом рефрактометрии (не ниже 65,0-85,0 г/л).
1.2 Обследование образцов крови:
а) полного клинического анализа, который проводится один раз на каждые 5 плазмодач;
б) подсчет количества тромбоцитов (1 раз на каждые 2 плазмодачи);
в) подсчет количества ретикулоцитов (1 раз на каждые 5 плазмодач);
г) функциональных проб печени (содержание билирубина в крови не выше 20,5 мк моль/л; тимоловая проба — 0-5 ед.; активность аланинамино-трансферазы от 0,1 до 0,68 ммоль/час-л);
д) иммуноферментного исследования на HBs-антиген, наличие антител к HCV и ВИЧ-1/2, сифилис.
1.2.1 Термометрия (допустимые пределы температуры тела 36,6 ± 0,3 °C).
1.3 Измерение артериального давления (пограничные значения-110/70-140/90мм рт. ст. с учетом возраста донора).
1.4 Подсчет частоты пульса донора ( ритмичный в пределах 60-80 пульсаций в 1 минуту).
1.5 Физикальный осмотр донора терапевтом, и дерматовенерологом, наркологом.
Если интервал между процедурами плазмафереза больше 2-х месяцев, донор обследуется как первичный. Если возраст донора более 40лет, то 1раз в год ему надо сделать электрокардиограмму.
Доноров плазмы нецелесообразно допускать к кроведаче, потому что это нарушает цикличность плазмаферезов. В то же время, донор крови может быть допущен к процедуре плазмафереза.
В случае проведения аппаратного плазмафереза доза изъятой плазмы зависит от массы тела донора, роста, общего количества белка крови и показателей гематокрита. Ее определяют по соотношениям между показателями, которые приведены в приложении 3 таблиц 1 — 2 — для мужчин; 3 — 4 — для женщин.
К плазмаферезу допускаются доноры всех групп крови.
При проведении мануального плазмафереза делают перерыв на 1 месяц после первых 5-ти процедур с объемом изъятой плазмы до 3 литров. При повторном цикле плазмаферезов (7 процедур) с объемом плазмы 4,5 литров, перерыв увеличивается до 2-х месяцев. При проведении третьего цикла плазмафереза (7-процедур) с объемом изъятой плазмы, как во втором цикле, перерыв увеличивается до 3-х месяцев.
При проведении аппаратного плазмафереза делают перерыв на 1 месяц после первых 5-ти плазмаферезов с объемом изъятой плазмы до 3-х литров. При повторном цикле плазмафереза (6 процедур) с объемом изъятой плазмы 4,5 литра, перерыв увеличивается до 2-х месяцев. При проведении третьего цикла плазмафереза (6 процедур) с объемом изъятой плазмы 4,5 литра, перерыв увеличивается до 3-х месяцев.
2. Контроль за состоянием здоровья донора в процессе плазмафереза
Повторные плазмаферезы следует проводить под наблюдением, которое включает детальный осмотр доноров терапевтом и весь комплекс лабораторных исследований, перечисленный в разделе 1 (кроме протеинограммы, общего анализа крови и мочи, которые проводят после каждого перерыва).
В случае отклонения от нормальных величин любого из перечисленных показателей, донора временно не допускают к плазмаферезу. Возможность оставаться в рядах доноров решает врач-трансфузиолог (терапевт).
3. Организация проведения донорского плазмафереза
Процесс плазмафереза включает взятие крови и реинфузию клеток крови, и требует соблюдения действующего законодательства Донецкой Народной Республики.
3.1 Проведение плазмафереза разрешается осуществлять одновременно нескольким донорам одной группы крови и резус – принадлежности, исходя из возможностей помещения и одновременного центрифугирования взятых доз крови.
3.2 Возвращать собственные форменные элементы крови следует последовательно каждому донору данной группы. Пробу на совместимость обязательно проводят перед каждой реинфузией.
3.3 При использовании специальных систем для плазмафереза, которые имеют многозначные индивидуальные номера на соединительных трубках, пробу на совместимость не проводят, а идентификацию донора и его форменных элементов осуществляют по указанным индивидуальным номерам.
3.4 В случае систематического проведения плазмафереза у одних и тех же доноров, целесообразно выделить отдельные дни для каждой группы крови.
4. Методика проведения мануального плазмафереза
У донора берут кровь в пластикатную тару (контейнер), отделяют форменные элементы крови путем центрифугирования и переводят плазму из контейнера с кровью в контейнер-приемник плазмы, отделяют контейнер с форменными элементами, идентифицируют и возвращают донору. Для проведения двукратного плазмафереза после окончания реинфузии первой дозы форменных элементов сразу же приступают к взятию второй дозы крови. В периоды центрифугирования, донору капельно вводят 200,0-250,0 мл 0,9% раствора натрия хлорида.
Для ускорения реинфузии, в контейнер с форменными элементами разрешается вводить 100,0 мл 0,9% раствора натрия хлорида. Процедура плазмафереза должна выполняться путем одной венепункции. Для этого применяют специально изготовленные для проведения плазмафереза одноразовые поливинилхлоридные системы. Весь процесс двукратного плазмафереза, от начала взятия первой дозы крови до окончания реинфузии второй дозы форменных элементов, должен занимать не более 90 минут.
4.1. Порядок взятия крови у донора
Перед началом взятия крови необходимо выяснить у донора его фамилия, имя и отчество, группу крови, резус-принадлежность и сверить их с записями в карте донора и на этикетках контейнера, в который будет производиться забор крови.
Паспортизацию пластиковых контейнеров проводят до начала взятия крови у донора методом нанесения сведений на этикетку (индивидуальный № донора, группа крови, резус-фактор, дата заготовки, вид продукции, срок годности).
Проверяют герметичность пластикатного контейнера, срок хранения изделия согласно инструкции завода-изготовителя.
При использовании спаренных контейнеров перевести весь консервирующий раствор в контейнер вместимостью 450-500 мл и наложить зажим на соединительную трубку между контейнерами.
На донорской трубке на расстоянии 15-20 см от контейнера сделать петлю узла и наложить зажим между узлом и иглой. Перенести контейнер на весы или на аппарат для дозированного взятия и смешивания крови с консервирующим раствором, которые располагают на 50-60 см ниже уровня руки донора.
Наложить жгут, обработать кожу локтевого сгиба донора антисептиком.
Снять колпачок с иглы и провести венепункцию, снять зажим с трубки. Кровь, поступающая в контейнер, должна тщательно смешиваться с консервирующим раствором. После взятия дозы крови наложить зажим на трубку ближе к игле, туго затянуть узел на донорской линии системы и отрезать ножницами трубку между узлом и зажимом ближе к узлу. На отрезке трубки, что осталась возле контейнера, завязать еще два узла или герметизировать с использованием ПВХ запаивателя.
Снять зажим с трубки. Наполнить кровью две пробирки, промаркированные перед венепункцией. Одну из них оставить для проведения пробы на совместимость перед реинфузией донору собственных форменных элементов крови, вторую отправить на клинико-биохимические, иммунологические, серологические исследования. На контейнер с кровью наклеить этикетку с данными донора.
После отсоединения контейнера с кровью от вены донора и взятия крови в пробирки необходимо герметизировать донорский конец трубки наложением узла. Жгут снять. Для предупреждения тромбирования крови в трубке, необходимо сразу начать инфузию 200,0 мл 0,9% раствор натрия хлорида.
4.2. Контейнер с кровью, упакованный в полиэтиленовый мешок, помещают в металлический стакан центрифуги. Цетрифужные стаканы уравновешивают на весах.
Для получения плазмы и эритроцитов пластикатные контейнеры с кровью центрифугируют 20 мин. в режиме 2000 g при температуре 10+15º С.
4.3. Отделение донорской плазмы.
После центрифугирования пластикатний контейнер осторожно, чтобы не взболтать кровь, устанавливают между пластинами плазмаэкстрактора. Снимают зажим между контейнерами. Легким нажимом руки на мешок с отцентрифугованой кровью, заполняют соединительную трубку с плазмой, которая по принципу сообщающихся сосудов, самотеком поступает в контейнер-приемник. Не допускается перевод в плазму форменных элементов крови. При необходимости проводят повторное центрифугирование плазмы и выделяют клетки крови в пустой мешок. Сведения о плазме вписывают в этикетку.
Образец этикетки:
Название Центра (СПК, ОПК, ОТ) заготовки крови______________
Индивидуальный № донора__________
вид плазмы, количество в ___ мл,
группа крови __________,
Дата заготовки плазмы: число__________, месяц__________, год_____
срок хранения плазмы
Подпись врача
Штрих код
Выход плазмы из одной дозы крови, должен составлять не менее 50% заготовленного объема.
4.4. Возврат (реинфузия) донору собственных форменных элементов крови
Реинфузию собственных клеток крови проводят в том же помещении, где осуществлялось взятие крови (СПК, ОПК, ОТ).
Использование индивидуально пронумерованных систем и контейнеров при плазмаферезе позволяет осуществлять идентификацию донора и его форменных элементов крови без проведения проб на совместимость, что сокращает время пребывания донора в центре крови.
4.4.1. Перед началом реинфузии необходимо выполнить следующие действия:
— спросить фамилию у донора и сверить с фамилией, написанной на этикетке контейнера,
— сверить номер марки плазмодачи и групповую принадлежность на этикетке контейнера с номером марки и группой крови на пробирке с кровью донора, если все данные совпадают, то необходимо показать донору его контейнер с форменными элементами и получить подтверждение,
— провести пробу на совместимость эритроцитов донора с одногруппной сывороткой.
4.4.2. Проверить этикетку на флаконе с 0,9% раствором натрия хлорида (пригодность к внутривенному введению, дату заготовки или срок годности).
4.4.3. Использовать V-образную систему для переливания крови, присоединив ее к контейнеру с форменными элементами крови, предварительно обработав трубку контейнера 70º этиловым спиртом и с помощью трех зажимов, размещенных на трубках системы, ввести 0,9% раствор натрия хлорида в контейнер в количестве 50% заготовленного объема крови, смешать форменные элементы крови с раствором.
Не разрешается использовать начатый флакон с 0,9% раствором натрия хлорида для другого донора.
4.4.4. При соответствии групповой принадлежности эритроцитов донора и пробы на совместимость, приступить к реинфузии эритроцитов.
4.4.5. Врач, который проводит донорский плазмаферез, заносит в журнал данные о проведении плазмафереза и ставит свою подпись. Во время реинфузии врач постоянно контролирует самочувствие донора. При возникновении реакций, реинфузию форменных элементов крови мгновенно прекращают, выясняют их причину и донору предоставляют медицинскую помощь.
4.4.6. При исполнении двукратного плазмафереза, взятие второй дозы крови начинают после возврата всего объема форменных элементов крови донору.
4.4.7. По завершении процедуры плазмафереза, иглу из вены донора извлекают и накладывают тугую асептическую повязку.
4.4.8. Контейнер с остатками эритроцитов хранят в течение 24 часов в холодильнике при температуре +4+6°C для выяснения причины возникновения реакций осложнений в посттрансфузионный период.
5.1. Аппаратный плазмаферез может выполняться в одном помещении одновременно донорам различных групп крови.
5.2. До начала плазмафереза необходимо проверить соответствие фамилии и номера карты лица, которому проводят плазмаферез. Перед каждым плазмаферезом донора взвешивают. Лицу, масса тела которого меньше 50,0 кг, согласно рекомендациям ВОЗ, отказывают в донорстве. При уменьшении массы тела донора в течение двух месяцев более 4,5 кг, его должен осмотреть врач.
Получения плазмы современными аппаратами осуществляют согласно инструкции завода-изготовителя.
В большинстве аппаратов плазмасобирающая система работает по стандартным параметрам. Скорость взятия крови у донора не должна превышать 70,0 мл/мин. (при необходимости она может быть снижена, но не ниже 60,0 мл/мин.). Эти же параметры определяют скорость реинфузии компонентов крови. Скорость центрифугирования в аппарате является неизменным параметром (компьютерная программа).
5.4. Процесс подготовки аппарата к плазмаферезу включает ряд этапов:
— Сепаратор, соединительные трубки и иглы проверить на проходимость и герметичность,
— установить сепаратор в центрифугу,
— асептически присоединить к нему соединительные трубки и пакет для плазмы.
— зафиксировать сепаратор,
— установить фильтровальную камеру,
— заполнить систему антикоагулянтом,
— вставить трубку в помпу для антикоагулянта,
— вставить трубку в насос для крови,
— включить помпу подачи антикоагулянта и взятия крови и заполнить ими соответствующие системы.
5.5. Перед проведением венепункции медицинская сестра должна:
— проверить идентичность номера на контейнерах для плазмы и емкостях для образцов крови, правильность записи назначенной дозы взятия плазмы.
— подвесить контейнер к весам взвешивания плазмы и запрограммировать аппарат на своевременное прекращение процедуры, руководствуясь записью врача в донорской карте.
5.6. Порядок проведения венепункции:
— записать марку и номер аппарата в карту донора,
— провести венепункцию с соблюдением правил асептики и антисептики,
— взять образец цельной крови для исследования,
— присоединить иглу к системе, соблюдая правила асептики, начать взятие крови, нажав кнопку «Пуск».
5.7.1. После взятия определенной дозы плазмы, процедура автоматически заканчивается.
5.7.2. Отметить количество взятой плазмы в карте донора.
5.7.3. В случае несоответствия конечного веса плазмы, (более чем на 5,0 г или менее чем на 20,0 г, изменение веса полученной плазмы указать в графе «Комментарии» карты донора.
5.7.4. В случае отклонения аппарата от программы, необходимо записать номер аппарата, причину отклонения, какие меры проведены (например, дополнительная калибровка), в соответствующую форму, которая ведется для каждого аппарата отдельно.
5.7.5. Если причина отклонений не установлена, перед дальнейшим использованием аппарата необходимо убедиться в правильной калибровке его весов, используя стандартные весы. Записать результаты в соответствующую форму.
5.7.6. Кровь, что осталась в системе трубок, вернуть донору.
После этого отсоединить систему от донора по такой схеме: удалить пластырь, фиксирующий иглу; наложить стерильный ватный тампон на место венепункции; удалить иглу; прижать стерильный тампон, наложить повязку на руку донора; иглу поместить в контейнер для обеззараживания. Донор должен оставаться в кресле в течение 5-10 минут для предупреждения возможного развития трансфузионных реакций.
5.7.7. Для взятия 2-х образцов плазмы необходимо: снять колпачок с трубки пакета с плазмой, удалить воздух из пакета через открытое отверстие трубки; закрыть отверстие этой трубки; заполнить трубку плазмой; промаркировать все образцы наклеек с контрольными номерами, убедиться, что все они имеют тот же номер, что и пакет с плазмой (длина трубки каждого образца должна быть 25-30 см).
5.7.8. Конечный объем собранной плазмы записать на пакете, в карте донора и операционном журнале, переводя единицы веса (г) в единицы объема (мл). Плазма должна быть заморожена в кротчайший срок, не позже 4-х часов с момента заготовки.
5.7.9. Если во время проведения плазмафереза по каким-либо причинам донор потерял 500,0 мл цельной крови или 250,0 мл эритроцитов, необходимо освободить его от плазмадачи на 2 месяца. В карте донора сделать запись о дате возобновления взятия плазмы и причине изменения сроков. Повторный плазмаферез проводят после оценки клинико-биохимических показателей крови донора.
6. Бактериологический контроль плазмы
Бактериологический контроль плазмы проводят согласно « Инструкции по контролю стерильности консервированной крови, ее компонентов, препаратов, кровезаменителей, консервирующих растворов».
7. Эксплуатация и обслуживание аппарата для проведения плазмафереза
7.1. Информацию о нарушениях в работе аппарата необходимо заносить в соответствующий журнал.
7.2. Проверку и калибровку аппаратов должен проводить квалифицированный инженерно – технический персонал в соответствии инструкции фирмы производителя.
7.3. Обслуживание и ежегодная профилактика аппаратов проводится квалифицированным техническим персоналом в соответствии с планом регламентированных работ и требований инструкции фирмы производителя. Данные обслуживания фиксируют в соответствующем журнале.
7.4. Если кровь или плазма попали на одну из частей аппарата (помпу, детекторы воздуха, монитор, замок центрифуги), необходимо остановить процедуру плазмафереза, нажав кнопку «Стоп» и выключить аппарат от энергосети; отсоединить донора, если кровь или плазма вытекают в результате нарушения герметичности в одной из частей системы (магистральная трубка, антикоагулянтная система, сепаратор, пакеты для плазмы).
Возврат донору клеток крови в этих случаях недопустим, в связи с возможным их бактериальным или другим загрязнением. Процедура плазмафереза может быть продолжена на другом аппарате.
7.5. При очищении и мытье аппарата необходимо придерживаться инструкции фирмы изготовителя. Открыть заднюю панель аппарата и убедиться в отсутствии вытекания жидкости во внутренней его части. Если жидкость не выявлена, аппарат может использоваться для плазмафереза, если выявлена, то необходимо провести очищение всех доступных частей. Дальнейшую работу по проверке и очищению аппарата, должен провести технический персонал. Все выявленные недостатки аппарата следует задокументировать в журнале.
8. Мероприятия по оказанию неотложной медицинской помощи донорам
Все случаи реакций у доноров должны быть занесены в раздел «Комментарии» карты донора.
Набор медикаментов и расходных материалов и проведение неотложной терапии при реакциях и осложнениях:
8. Острая сосудистая недостаточность.
Необходимые средства:
— нашатырный спирт;
— кислород;
— кофеин 2,0 мл;
Мероприятия:
— приведение донора в положение Тренделенбурга (голова ниже ног);
— нашатырный спирт поднести к носу донора на ватном тампоне;
— ингаляция увлажненного кислорода;
— кофеин 2,0 мл внутримышечно.
Необходимые средства:
— кофеин 2,0 мл;
— мезатон 1,0 мл;
— 0,9 % раствор хлористого натрия 200,0 мл;
— преднизолон 90,0 мг;
Мероприятия:
— приведение донора в положение Тренделенбурга;
— ингаляция увлажненного кислорода;
— преднизолон 90,0 мг внутривенно;
— кофеин 1,0 – 2,0 мл внутривенно.
При отсутствии эффекта, внутривенно – 0,5 мл мезатона в 10,0 мл 0,9% раствора хлористого натрия.
Необходимые средства:
— анальгин 50%
— димедрол 1%;
— платифилин 2,5%;
— преднизолон 90,0 мг;
— реополиглюкин 400,0 мл;
— нитросорбит.
Мероприятия:
— нитросорбит под язык;
— ингаляция увлажненного кислорода.
При отсутствии эффекта, внутримышечно 2,0 мл анальгина, 1,0 мл димедрола, 2,0 мл платифилина.
При развитии кардиогенного шока внутривенно- 90,0мг преднизолона и 0,5 мл мезатона, инфузия реополиглюкина.
8.4. Острая сердечная недостаточность
Симптомы: отдышка, холодный пот, бледность, тахикардия (брадикардия), гипотензия. Острая боль в области грудной клетки может быть симптомом коронарной недостаточности, инфаркта или эмболии легочной артерии.
Мероприятия:
— остановить процедуру плазмафереза (в зависимости от состояния донора возвратить ему клетки крови);
— перевести донора в полусидячее положение наладить вдыхание кислорода в количестве 3 литра в минуту;
— вызвать специализированную кардиологическую бригаду скорой медицинской помощи;
— при выявлении признаков у донора воздушной эмболии перевести его в положение Тренделенбурга и дать кислород;
— провести детальное описание состояния и оказания медицинской помощи в карте донора.
Симптомы:
— тремор, лихорадка, отдышка, ощущение страха.
Мероприятия:
— остановить процедуру плазмафереза;
— перевести донора в полусидячее положение, накрыть одеялом;
— при повышении температуры провести десенсибилизирующую терапию(10% раствор хлористого кальция, 1% раствор димедрола);
— при необходимости наладить дыхание кислорода в количестве 3 л в минуту;
— через каждые 15 минут измерять следующие показатели: температуру тела, пульс, артериальное давление до полной стабилизации состояния;
— при отсутствии эффекта, госпитализировать донора в лечебное учреждение;
— сохранять флаконы с раствором, которые вызвали реакцию не меньше 72 часов;
— детально описать реакцию и оказание медицинской помощи в карте донора.
Необходимые средства:
— преднизолон для внутривенного введения 90,0мл;
— мезатон 1,0 мл;
— димедрол 1%;
— препарат высокомолекулярного декстрану или оксиэтиленового крахмала (пулифер);
— 0,9 раствор хлористого натрия 200,0 мл.
Мероприятия:
— ингаляция увлажненного кислорода;
— преднизолон 90 мл внутривенно;
— мезатон 0,5 мл внутривенно;
— диметрол 2,0 мл в 0,9% растворе хлористого натрия (10 мл). При отсутствии эффекта, проводится инфузия препарата высокомолекулярного декстрана или оксиэтиленового крахмала.
8.7. Клиническая смерть (остановка сердечной деятельности).
Необходимые средства:
— адреналин 0,1% — 1,0 мл;
— атропин 0,1 % — 1,0 мл;
— 0,9% раствор хлорида натрия 200,0 мл.
Мероприятия:
При остановке сердца донора необходимо уложить на ровную твердую поверхность, зафиксировать время, провести механическую дефибриляцию сердца (короткий резкий удар ребром ладони или кулаком по грудине), при отсутствии эффекта зафиксировать язык языкодержателем, ввести дыхательную трубку; начать искусственное дыхание (рот в рот), одновременно проводить закрытый массаж сердца. При отсутствии эффекта проведенных реанимационных мероприятий провести электродефибриляцию сердца током от 3 до 5,5 кв, внутрисердечно ввести: 1,0 мл адреналина, 1,0 мл атропина, 5,0 мл 10% раствора кальция хлорида. На голову донора положить лед или полотенце смоченное холодной водой.
При каких либо осложнениях одновременно с оказанием неотложной медицинской помощи необходимо вызвать специализированную бригаду скорой медицинской помощи.
Перечень оснащения, необходимого для оказания неотложной медицинской помощи.
1. Ручной дыхательный аппарат типа АДР-1 или дп-10- 2 шт. или «Амбу».
2. Языкодержатель – 2 шт.
3. Дыхательная трубка – 2 шт.
4. Шприцы разового использования – на 10,0 мл – 10 шт., на 5,0 мл – 10 шт.
5. Иголки одноразового использования для внутривенных и внутримышечных инъекций – 20 шт.
6. Иголки для внутрисердечных инъекций – 2 шт.
7. Ватные тампоны – 10 шт.
8. Спирт этиловый 70º — 50,0 мл.
9. Системы для внутривенного введения инфузионных растворов – 5 штук.
10. Дефибриллятор – 1 шт.
Режимы центрифугирования консервированной крови заготовленной в пластикатный контейнер при проведении мануального плазмафереза
Режим фракционирования Марки центрифуг Разделение крови на эритроциты и плазму РС-6 МРW 2000 g
20 мин, t+15ºС2000 g
20мин, t+15ºСОборудование, аппаратура, расходный материал необходимые для проведения ручного (мануального) плазмафереза
1. Рефрижераторная центрифуга (емкость стаканов 0,75-1,0л).
2. Запаиватель ПВХ – трубок или металлические кольца и зажимное устройство.
3. Плазмаэкстракторы.
4. Весы.
5. Штатив для подвешивания пластикатных контейнеров.
6. Бикс со стерильным материалом (тупфера, перевязочный материал, ватные шарики, медицинские инструменты – ножницы, зажимы и др.).
7. Пластикатные контейнеры различных модификаций (для однократного и двукратного плазмаферезов).
8. Системы для переливания инфузионных сред.
9. Стерильный апирогенный 0,9% раствор натрия хлорида для внутривенного введения (200 мл, 400мл).
10. Этикетки для контейнеров с плазмой и кровью.
11. Одноразовые планшеты для определения групповой принадлежности.
12. Емкости для дезинфекции отработанного материала и медицинского инструмента.
Таблица 1
Определение буквенных символов номограммы для расчета веса плазмы (в граммах) у мужчин при автоматическом плазмаферезе по массе тела и росту
Масса тела донора, кг Рост, см 152–156 157–161 162–166 167–171 172–176 177–181 182–184 185 и выше 49,5–53,5 B B C C D D D E 54,0–58,0 B C C D D D E E 58,5–62,5 C C C D D D E F 63,0–67,0 C C D D E E F F 67,5–72,0 D D D E E E F F 72,5–76,0 D D E E E E F G 76,5–80,5 D D E E F F G G 81 и больше D D E F F F G G Таблица 2
Номограмма для расчета веса (в граммах) изъятой плазмы при автоматическом плазмаферезе в зависимости от гематокрита донора и буквенного символа из таблицы 1
Гематокрит донора, % Символы из таблицы 1 A B C D E F G 38,0–41,5 577 648 720 791 850 850 850 41,6–45,5 543 610 677 744 812 850 850 45,6–49,5 509 572 635 698 761 824 850 49,6–54,0 470 528 587 645 703 761 819 Таблица 3
Определение буквенных символов номограммы для расчета веса плазмы у женщин при автоматическом плазмаферезе по массе тела и росту
Масса донора, кг Рост, см 152–156 157–161 162–166 167–171 172–176 177–181 182–184 185 и выше 49,5–53,5 A A B B B C C D 54,0–58,0 A B B B C C D D 58,5–62,5 B B B C C D D E 63,0–67,0 B B C C D D D E 67,5–72,0 B C C D D D E E 72,5–76,0 B C D D D E E F 76,5–80,5 B C D D E E F F 81 и больше B C D D E F F F Таблица 4
Номограмма для определения веса (в граммах) изъятой плазмы при автоматическом плазмаферезе в зависимости от гематокрита донора и буквенного символа из таблицы 3
Гематокрит донора, % Символы из таблицы 3 A B C D E F G 38,0–41,5 577 648 720 791 850 850 850 41,6–45,5 543 610 677 744 812 850 850 45,6–49,5 509 572 635 698 761 824 850 49,6–54,0 470 528 587 645 703 761 819 Замораживание, хранение и доставка плазмы проводится согласно « Инструкции по фракционированию донорской крови на компоненты (плазма, эритроциты, лейкоциты) и их консервирование».
Плазма хранится в температурных режимах, соответствующих цели дальнейшего использования.
Интервалы между процедурами плазма – цитофереза (в днях)
Название процедуры Следующие процедуры Кроведача Плазмаферез Тромбо–цитоферез Лейко-цитоферез Кроведача 60 30 30 30 Плазмаферез: доза 250-300 мл
доза 500 – 600 мл
7-14 14
7-14 14
7-14 14
7-14 14
Тромбоцитоферез 14 14 14 14 Лейкоцитоферез 30 14 14 30
Инструкция по контролю стерильности консервированной крови, ее компонентов, препаратов, плазмозаменяющих и консервирующих растворов, условий их заготовки
Общие положения
Исследование на стерильность консервированной крови, ее компонентов, препаратов, кровезаменителей и консервирующих растворов проводят с целью выявления возможной контаминации аэробными и анаэробными микроорганизмами.
Контроль стерильности может осуществлять персонал бактериологических лабораторий станций переливания крови, а также центральных районных больниц и санэпидемстанций, в регионах которых расположены отделения переливания крови.
1. Требования, которые предъявляют к бактериологической лаборатории
1.1 Оборудование бактериологической лаборатории
Лабораторию размещают в специальном помещении, оснащение и оборудование которого приспособлено для выполнения исследований в асептических условиях и предотвращает заражение персонала.
В структуре лаборатории предусмотрены помещения специального назначения;
— лабораторная комната ;
— бокс и предбокс;
— термостатная;
— комната для приготовления питательных сред;
— стерилизационная;
— препараторская.
Лабораторная комната — светлое, просторное помещение для подготовительной работы в боксе и учета результатов исследований.
В лабораторной комнате должны быть:
— рабочие места врача и лаборанта, оснащенные бинокулярным световым микроскопом, газовыми или спиртовыми горелками, а также инструментами для бактериологических исследований;
— стол для окраски мазков;
— потенциометр;
— центрифуга;
— термостаты;
— холодильники для раздельного хранения питательных сред, реактивов и культур микроорганизмов.
Бокс — изолированное помещение для проведения бактериологических исследований в асептических условиях.
Бокс должен быть светлым, обеспеченным приточно-вытяжной вентиляцией и оборудованным бактерицидными лампами из расчета 1 лампа БУФ-30 на 12 м3 объема помещения или от 2 до 2,5 Вт на 1 м2 помещения. Лампы размешивают на потолке, стенах, над входом в бокс, выключатели располагают вне бокса.
Бокс должен быть оборудован рабочим и вспомогательным столами, табуретками, газовыми или спиртовыми горелками.
Оборудование боксов и конструкция мебели должны обеспечивать легкость и надежность дезинфекционной обработки. Газовые, водопроводные трубы и провод располагают в толще стен, батареи отопления должны быть ровными. Стены облицовывают метлахскими плитками или, как и потолок, красят масляной краской светлых оттенков. Пол покрывают линолеумом, метлахскими плитками или пластиком, что позволяет использовать для уборки дезинфицирующие растворы.
Для проведения контроля стерильности разрешается использовать настольные боксы с ламинарным потоком стерильного воздуха.
Предбокс с передаточным окном должен примыкать к боксу. В предбокс вносят материал, приготовленный для посева, питательные среды, пипетки и бикс со стерильным бельем. В предбоксе персонал готовится к работе в боксе.
В термостатной располагают термостаты для инкубирования бактериологических посевов при температуре от З0 до 35 ° C и от 20 до 25 ° С.
Комнату для приготовления питательных сред оборудуют рабочими столами, газовой или электрической плитой, шкафами для хранения сухих питательных сред, химических реактивов и лабораторной посуды, холодильниками.
В стерилизационной устанавливают оборудование для стерилизации посуды, питательных сред, одежды, обеззараживания отработанного материала.
Препараторская приспособлена для предстерилизационной обработки посуды. В ней должны находиться электрическая или газовая плита, рабочие столы, стеллажи и сушильные шкафы.
Перед входом в каждую комнату должен быть коврик, увлажненный дезинфектантом.
В бактериологической лаборатории должна быть холодная и горячая вода.
1.2 Подготовка бокса для работы
Ежедневно бокс и предбокс тщательно убирают и дезинфицируют путем протирания поверхности стен, пола, мебели стерильной тряпкой, которую смачивают в 4% растворе перекиси водорода с моющими средствами или в мыльно-содовом растворе (1% раствор соды или моющего средства и 0,5% нашатырного спирта), с последующим протиранием одним из дезинфицирующих растворов: 3% раствором хлорамина, 3% раствором фенола, 1% раствором кальция гипохлорита, раствором Антисептол или одним из иностранных дезинфектантов, зарегистрированных в Украине. Норма затрат дезинфицирующих растворов — 70-100 мл / м2.
За 1,5-2,0 ч до работы в боксе включают бактерицидные лампы. Воздух бактериологического бокса контролируют седиментационным методом не реже двух раз в неделю до и после работы. Для этого на рабочий стол ставят чашки Петри с мясопептонным и 5% кровяным агаром и открывают их на 15 мин. Посевы воздуха инкубируют в термостате при температуре от 30 до 35 ° С в течение (21 ± 3) ч, затем оставляют еще на (21 ± 3) ч при температуре от 20 до 25 ° С. В случае роста на любой чашке Петри более 3 колоний микроорганизмов в начале работы и более 15 — в конце проведение дальнейших работ запрещается и бокс подлежит тщательной обработке. Если в боксе выявлены спорообразующие бактерии, грибы или гемолитические формы микроорганизмов, концентрацию перекиси водорода для уборки увеличивают до 6%.
В случае появления колоний грибов применяют меры по снижению влажности в помещении (обогреватели и т.п.).
По окончании работы бокс проветривают. Инвентарь для уборки тщательно высушивают, тряпки стерилизуют и хранят в специально отведенном месте.
Один раз в год проводят санитарный ремонт бактериологического бокса и предбокса.
1.3. Подготовка лабораторной посуды и питательных сред
1.3.1. Подготовка лабораторной посуды для питательных сред
Новую лабораторная посуда кипятят в течение 30 мин в 1-2% растворе соляной кислоты, чтобы избежать вылущивания стекла, с последующим промыванием дистиллированной водой до нейтральной реакции. Посуду, бывшую в употреблении, моют горячей водой с моющим средством, промывают проточной водой, споласкивают дистиллированной водой и высушивают.
Предназначенные для стерилизации пробирки, колбы, бутылки закрывают ватно- марлевыми пробками. Шейки колб и бутылок обертывают бумажными колпачками. Чашки Петри и пипетки заворачивают в бумагу или помещают в металлические пеналы, лотки. Посуду стерилизуют паровым или воздушным методом.
1.3.2. Подготовка питательных бактериологических сред
Для бактериологического контроля консервированной крови, ее компонентов, препаратов, кровезаменителей и консервирующих растворов, а также условий их заготовки применяют такие питательные среды: питательная среда для контроля стерильности (тиогликолевая), среда Сабуро (жидкая) и 2% питательный агар ( кровяной и мясопептонный). «Входной» контроль каждой новой серии тиогликолевой среды предполагает оценку ее качества по стерильности и ростовым свойствам. Контроль качества каждой из последующих партий среды, приготовленной из одной серии сухого препарата прошедшего полный «входной» контроль, проводят только на стерильность.
Для оценки стерильности среды пробирки с образцами готовой тиогликолевой среды в объеме 10 мл и 20 мл после автоклавирования в количестве от 2 до 5% в зависимости от объема приготовленной партии помещают в термостат и выдерживают при температуре от 30 до 35 ° C в течение ( 45 ± 3) ч.Учет результатов осуществляют визуально. Среду Сабуро жидкую выдерживают при температуре от 20 до 25 ° C в течение (69 ± 3) ч.
В случае прорастания среды хотя бы в одной пробирке бракуют всю партию.
Образцы тиогликолевой среды, которые были выдержаны в термостате, для дальнейшей работы не используют.
Определение ростовых свойств тиогликолевой среды осуществляется с помощью тест-культур микроорганизмов:
Staph. aureus 209Р
Clostridium sporogenes 272.
Готовая к употреблению тиогликолевая питательная среда должна быть стерильной и обеспечивать рост тест-культур микроорганизмов. Срок хранения тиогликолевой питательной среды — 2 нед при температуре от 10 до 20 ° C в защищенном от света месте. Срок хранения среды Сабуро, мясопептонного бульона и мясопептонного агара — 3 мес при температуре от 4 до 10 ° C или 1 мес — при температуре от 18 до 20 ° С.
2. Бактериологический контроль условий заготовки
Объектами исследований при проведении бактериологического контроля условий заготовки являются:
— режим стерилизации;
— материал, подлежащий стерилизации;
— воздушная среда производственных боксов;
— руки персонала и кожа локтевых сгибов доноров.
2.1. Контроль режима работы паровых и воздушных стерилизаторов
Контроль режима работы стерилизаторов осуществляют физическим, химическим и бактериологическим методами.
2.1.1. Физический метод контроля.
Предназначен для оперативного контроля параметров режимов работы паровых и воздушных стерилизаторов (температура, давление, и время стерилизации, стерилизационной выдержки). Результаты контроля позволяют оперативно выявлять повреждения аппарата, контрольно-измерительных приборов и ориентировочно оценивать правильность загрузки стерилизатора в каждом конкретном случае.
Физический метод контроля работы стерилизаторов осуществляют путем измерения температуры, давления и времени.
Параметры режима работы стерилизатора следует проверять в течение цикла стерилизации.
Контроль параметров режимов работы паровых стерилизаторов
Контроль температурных параметров режима работы паровых стерилизаторов проводят с использованием термометров ртутных стеклянных максимальных с диапазоном измерения температуры от 0 до 150 ° C (ТП-7).Термометры нумеруют и размещают в разных местах стерилизационной камеры. По окончании цикла стерилизации регистрируют показатели термометров и сравнивают их между собой, а также с номинальной температурой стерилизации.
Отклонение в показателях максимальных термометров допустимы в указанных пределах.
Давление в стерилизационной камере парового стерилизатора измеряют с помощью мановакуумметра. Класс точности мановакуумметра должен быть не ниже 2,5. Предел измерения — от 0,1 до 0,5 МПа (от 1 до 5 кгс / см 2).
Хронометраж цикла стерилизации проводят с помощью механического секундомера (класс точности 2,0) или наручных механических часов с погрешностью суточного хода ± 1 мин.
Контроль параметров работы воздушных стерилизаторов
Контроль температурных параметров работы воздушных стерилизаторов в течение цикла стерилизации проводят путем наблюдения за показателями приборов, установленных на стерилизаторе (термометр, индикаторное оборудования на панели аппарата).
Распределение температур в середине загруженной стерилизационной камеры определяют, используя термометры ртутные стеклянные максимальные с диапазоном измерения температур от 0 до 200 ° C (ТП-25).Максимальные термометры нумеруют и размещают в разных местах камеры воздушных стерилизаторов. По окончании цикла стерилизации регистрируют показатели термометров и сопоставляют их с номинальной температурой стерилизации.
Отклонение в показателях максимальных термометров допустимо в указанных пределах.
Хронометраж цикла стерилизации проводят аналогично указанному выше.
Примечание. Правильность показателей максимальных термометров устанавливают путем погружения их в открытую емкость с кипящей водой на 6-7 мин (ртутный шарик термометра не должна касаться стенок сосуда). Если термометры показывают температуру (100 ± 1) ° С, их считают исправными.
Стерилизационные коробки не перегружают материалом, который стерилизуется. Свернутое хирургическое белье закладывают так, чтобы между ним свободно проходила рука. После извлечения средств контроля со стерилизационных коробок с изделиями без индивидуальной упаковки последние подлежат повторной стерилизации.
2.1.2. Химический метод контроля.
Предназначен для оперативного контроля одного или нескольких параметров режимов работы паровых и воздушных стерилизаторов
Химический метод контроля работы стерилизаторов проводят с помощью химических тестов и термохимических индикаторов.
Химический тест — это запаянная с обоих концов стеклянная трубка, заполненная смесью химического соединения с органическим красителем или только химическим соединением (веществом), которая меняет свое агрегатное состояние и цвет при достижении необходимой для нее температуры плавления.
Упакованные химические тесты нумеруют и размещают в разных местах стерилизационной камеры. По окончании стерилизации химические тесты вынимают из стерилизатора и визуально определяют изменения их агрегатного состояния и цвета. В случае положительного результата контроля химические тесты должны равномерно расплавиться и изменить цвет, что свидетельствует о достижении заданной температуры стерилизации.
Термохимические индикаторы предназначены для осуществления оперативного контроля одного или нескольких параметров режимов работы паровых и воздушных стерилизаторов.
Термохимический индикатор — это полоска бумаги, на которую нанесена термоиндикаторная краска.
Пронумерованные термохимические индикаторы размещают в разных местах стерилизаторов (прикрепляют на пакеты с контрольными тестами или на упаковки с изделиями, которые стерилизуются).
По окончании стерилизации термохимические индикаторы вынимают из стерилизатора и визуально определяют изменение их цвета.
В случае положительного результата контроля термохимические индикаторы должны изменить цвет на указанный в инструкции, что свидетельствует о соблюдении параметров режима стерилизации.
2.1.3. Бактериологический метод контроля
Бактериологический метод предназначен для контроля эффективности работы стерилизаторов на основе гибели спор микроорганизмов, находящихся в биотестах.
Биотестами могут быть образцы грунта или микробные тест-объекты.
Во время бактериологического контроля работы паровых стерилизаторов пронумерованые биопробы закладывают в упаковки с материалом, который стерилизуют. В каждую упаковку помещают по 2 пробы и 2 пробы закладывают за упаковками в верхней и нижней частях стерилизационной камеры.
По окончании стерилизации биотесты в тот же день доставляют в бактериологическую лабораторию, где проводят посев каждого биотеста в 2 пробирки с 10 мл тиогликолсвой среды (исследуемые пробы). Посевы инкубируют в термостате при температуре от З0 до 35°С в течение 7 суток.
Для контроля качества биотестов одну пробу оставляют в лаборатории без стерилизации, ее засевают и культивируют параллельно с опытными пробами.
В пробирке с посевом контрольного биотеста должен наблюдаться рост спорообразующих микроорганизмов. При отсутствии роста в контрольном биотесте устанавливают причину (нежизнеспособность тест-объекта, нарушения методики приготовления биотестов, питательных сред, культивирования).
В этом случае результаты бактериологического контроля аннулируют и повторяют контроль работы стерилизатора.
Ни в одной из исследуемых пробирок не должно быть роста спорообразующих микроорганизмов.
При наличии роста спорообразующих микроорганизмов хотя бы в одной из исследуемых пробирок бактериологический контроль повторяют.
Стерилизатор можно использовать после устранения неисправностей и получения положительных результатов физического, химического и бактериологического контроля.
Методика приготовления биопроб грунта
Образцы почвы высушивают на воздухе, измельчают в ступке и просеивают через мелкое сито.
Образцы грунта массой (3,0 ± 0,5) г помещают в бактериологические пробирки, закрывают ватно-марлевыми пробками и упаковывают в бумагу.
Пробы, не менее 3 от каждого образца грунта, помещают в паровой стерилизатор и после продувки доводят давление пара в автоклаве до (0,11 ± 0,02) МПа ((1,1 ± 0,2) кгс / см2) при температуре ( 121 ± 1) °C — экспозиция — 5 мин. Подъем давления в течение 8 мин, спуск пара — 3 мин. Ограничение времени подъема давления и спуска пара необходимо для уменьшения времени действия пара на микрофлору почвы, после чего пробы грунта подлежат бактериологическому исследованию.
В тех случаях, когда во время экспозиции 5 мин во всех пробирках с засеянными пробами грунта нет роста, в случае дальнейшей проверки экспозицию сокращают до 3 мин.
Если и при такой экспозиции все пробы почвы окажутся стерильными, образец почвы считают непригодным для контроля паровых стерилизаторов.
Подсушенный, просеянный, маркированный образец почвы, содержащей термостойкие спорообразующие микроорганизмы, необходимо хранить в емкости с притертой пробкой при комнатной температуре в защищенном от света месте. Срок использования его для бактериологического контроля режимов работы паровых стерилизаторов составляет 7 мес. Через 3-4 мес проверяют сохранность термостойкости микрофлоры в этом образце грунта.
2.2. Контроль простерилизованного материала
Стерильный материал необходимо хранить в специальном помещении.
Контаминацию воздуха помещений для хранения стерильного материала проверяют не реже 1 раза в неделю (п. 1.2).
Предполагается рост не более 10 колоний сапрофитов. Стерильность изделий определяют не реже одного раза в неделю перед началом работы и не менее чем с 3 образцов одного вида, которые были простерилизованы в одном стерилизаторе. Посев каждого образца изделий (или их отдельных узлов и составных частей) осуществляют в две пробирки, содержащие по 10 мл тиогликолевой среды. Посевы помещают в термостат: одну пробирку выдерживают при температуре от З0 до 35 °С, вторую — от 20 до 25 °C в течение 8 суток (в случае контроля изделий, которые были простерилизованны паровым или воздушным методом).
Посев на стерильность ампул, игл и шприцов малой емкости, а также образца резиновой трубки с иглой от системы для взятия крови многоразового использования проводят путем погружения их в пробирки с тиогликолевой средой.
Стерильность белья, хирургических инструментов, резиновых перчаток, внешние и внутренние поверхности шприцев большой емкости контролируют путем смывов стерильными тампонами, которые смачивают в стерильном изотоническом растворе натрия хлорида, а затем вносят в пробирки с тиогликолевой средой.
Стерильность посуды проверяют путем смывов с внешней и внутренней поверхности. Смыв с внешней поверхности проводят стерильными тампонами, которые смачивают в стерильном изотоническом растворе натрия хлорида; смыв с внутренней поверхности проводят путем ополаскивания ее 10 мл стерильного изотонического раствора натрия хлорида и по (1,0 ± 0,1) мл засевают в пробирки с питательной средой.
2.3. Контроль микробной контаминации воздуха производственных боксов
Подготовку боксовых помещений к работе и бактериологический контроль воздуха проводят согласно п.1.2.
2.4. Контроль эффективности обработки рук персонала производственных боксов и кожи локтевых сгибов доноров
Руки персонала, который работает в производственных боксах, один раз в неделю проверяют на стерильность следующим образом: пальцами касаются поверхности мясопептонного агара в чашке Петри, плотно прижимают их, не повреждая питательной среды, и делают несколько круговых движений. Чашки Петри с посевами термостатируют при температуре от З0 до 35°С в течение (45 ± 3) ч.
Кожу локтевых сгибов после соответствующей обработки контролируют 2 раза в неделю в 3% доноров путем смывов стерильными марлевыми салфетками 4×4 см, увлажненными стерильным раствором нейтрализатора (для нейтрализации йода используют 1% раствор натрия гипосульфита, для нейтрализации катион- активных кожных антисептиков — 0,2% раствор сульфанола в 10% растворе обезжиренного молока).
После смывов салфетки помещают в пробирки или колбы с 20 мл нейтрализатора или стерильного изотонического раствора натрия хлорида со стеклянными бусами и встряхивают в течение 10 мин, после чего по 0,5 мл жидкости пипеткой переносят в чашки Петри и заливают охлажденным до температуры 45 °C 2% мясопептонным агаром. Салфетки погружают в пробирки с 10 мл тиогликолевой среды. Оба посевы инкубируют в термостате при температуре от 30 до 35° C в течение (45 ± 3) ч.
Посевы рук медицинского персонала и кожи локтевых сгибов доноров должны быть стерильными.
3. Исследование на стерильность образцов консервированной крови, ее компонентов, препаратов, плазмозамещающих и консервирующих растворов
Образец для контроля — это количество препарата, необходимое для посева на питательную среду.
3.1 Отбор образцов при производственном контроле
Отбор образцов проводят от каждого бокса, стерилизатора, стерилизующей системы, сублимационного аппарата.
Контроль стерильности консервированной крови и ее компонентов проводят путем исследования образцов, избирательно взятых из общего количества заготовленных емкостей.
Количество проб крови составляет 2% от числа заготовленных бутылок или 1% от числа заготовленных полимерных контейнеров, но должно быть не менее одной пробы.
Компоненты (препараты) крови — эритроцитную массу, эритроцитную взвесь, плазму нативную, в том числе иммунную, криопреципитат и т.д. — отбирают объемом от З до 5 мл в пустые стерильные флаконы в начале, в середине и в конце работы производственного бокса.
Компоненты, заготовленные в полимерные контейнеры, отбирают выборочно в количестве 1% от числа заготовленных емкостей, но не менее одного образца.
Концентраты лейкоцитов, тромбоцитов и отмытые размороженные эритроциты не контролируются, так как они должны быть использованы в течение 24 часов с момента заготовки.
Препараты крови и плазмозаменителей — растворы альбумина, иммуноглобулинов, полибиолин, аминокровин и т.д. контролируют в процессе стерилизующей фильтрации и розлива. Для контроля отбирают не менее чем по 5 мл в начале, в середине и в конце розлива в пустые стерильные флаконы (ампулы).
В случае разлива препаратов, в дальнейшем подлежащих лиофильной сушке, до окончания контроля стерильности оставляют удвоенное количество образцов для возможного исследования.
Полибиолин контролируют:
— после сублимационной сушки в бутылках, отбирая по одному образцу от каждой кассеты, этажерки или полки; затем в процессе стерильной расфасовки — каждый тридцатый флакон готового препарата
— после сублимационной сушки готового препарата во флаконах — по два образца от каждой кассеты-лотка.
3.2 Отбор образцов, проводит отдел технического контроля
В отдел технического контроля предъявляют готовую серию препарата.
Готовая серия препарата — это совокупность емкостей, которые были разлиты из одной емкости в течение не более 4 ч работы, запаянных или герметизированных тем или иным путем, что обеспечивает отсутствие контаминации во время разлива или высушивания. Для сухих препаратов — это количество бутылок, флаконов или ампул с препаратом, которые были высушены в одном аппарате за один цикл сушки. Для продукции, подлежащей автоклавированию, — это количество емкостей с препаратом, которые были простерилизованные в одном автоклаве.
Образцы готовой продукции отбирают для контроля от каждой серии в количествах, которые зависят от вида стерилизации и числа емкостей в серии.
Для определения минимального количества емкостей (единиц), необходимых для контроля стерильности, следует провести расчет по формуле:
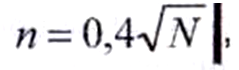 Где N — количество единиц в исследуемой серии препарата, при этом n должно быть от 3 до 40 единиц.
Где N — количество единиц в исследуемой серии препарата, при этом n должно быть от 3 до 40 единиц.
3.3. В случае, если продукцию стерилизуют паром под давлением (0,11±0,02) МПа ((1,1±0,2) кгс/см2) и температуре (121±1) °С, для контроля отбирают 10 единиц.
Кроме образцов, направленных непосредственно на исследование стерильности, отбирают дубликаты в двойном количестве, которые используют в случае повторного контроля.
При отсутствии роста в первичных посевах дубликаты подлежат реализации.
Для проведения предварительного и арбитражного государственного контроля стерильности отбирают по 2 бутылки от серии; флаконы, ампулы — не менее 4 от серии. Количество емкостей с препаратами иммуноглобулинов — в соответствии с формулой.
Для проведения дальнейшего государственного контроля направляют по одной бутылке от серии; флаконов, ампул — не менее 2 от серии; количество емкостей с иммуноглобулинами рассчитывают по указанной формуле.
3.4 Техника проведения контроля стерильности
В предбоксе бутылки, флаконы, ампулы, полимерные контейнеры с препаратами проверяют на наличие этикеток, на герметичность, затем протирают 4% раствором перекиси водорода или 70% этиловым спиртом.
Образцы, поступающие в тканевой или бумажной упаковке, перед внесением в бокс от нее избавляют.
Специалисты, которые осуществляют контроль стерильности, непосредственно перед работой в боксе тщательно моют руки с мылом, вытирают их стерильным полотенцем, одевают стерильные халаты, шапочки или косынки, четырехслойные марлевые маски, бахилы или боксовую обувь. В боксе руки обрабатывают 70% этиловым спиртом.
Для работы используют стерильные пипетки, закрытые ватными пробками, резиновые груши, простерилизованные инструменты, которые во время работы находятся в емкости с 96% этиловым спиртом.
Перед посевом жидких образцов содержимое бутылок, флаконов, ампул встряхивают, концы ампул и шейки флаконов, бутылок фламбируют.
Лиофилизированные образцы растворяют тем же растворителем и в том же объеме, которые указаны на этикетке продукта.
— Посев каждого образца проводят в толщу питательной среды без выдувания отдельной пипеткой с помощью груши без предварительного прокаливания в пламени горелки. Использованные пипетки помещают в дезинфицирующий раствор.
Образцы, исследуемые на стерильность, засевают не менее чем по 1 мл каждый в две пробирки, содержащие по 20 мл тиогликолевой среды. При посеве плазмозамещающих и консервирующих растворов, кроме тиогликолевой среды, используют одну пробирку с 20 мл среды Сабуро (жидкой). Параллельно две пробирки с тиогликолевой средой и одну со средой Сабуро оставляют незасеянными для контроля стерильности питательных сред на весь период инкубации исследуемых образцов. Посевы в тиогликолевой среде и контрольные пробирки инкубируют в термостате при температуре от 20 до 25 ° С и при температуре от 30 до 35 ° С, со средой Сабуро — при температуре от 20 до 25 ° С.
Срок инкубации посевов в термостате в обоих питательных средах составляет 14 суток.
В случае посева образцов крови и компонентов, заготовленных в полимерных контейнерах, трубку контейнера зажимают выше узла и отрезают между узлом и зажимом. Обрезанный конец трубки быстро проводят сквозь пламя, вводят в него пипетку, ослабляют зажим и путем нажатия на контейнер набирают в пипетку не менее 2 мл материала.
Посевы образцов консервированной крови, эритроцитной массы, эритроцитной взвеси, нативной плазмы, в том числе иммунной, выдерживают двое суток при соответствующей температуре, после чего проводят посев по 0,5 мл с каждой пробирки в другие две пробирки, содержащие по 10 мл тиогликолевой среды.
Пересев инкубируют при тех же температурах, что и пробирки, из которых был проведен посев. Результаты регистрируют через сутки после пересева.
При контроле образцов препаратов, не вызывающих помутнение питательной среды (альбумин, препараты иммуноглобулинов, плазмозамещающие и консервирующие растворы). посевы инкубуют 14 суток при соответствующей температуре.
В случае контроля образцов препаратов, вызывающих помутнение питательной среды (полибиолин), через 7 суток с каждой пробирки делают пересев по 0,5 мл в другие две пробирки с 10 мл тиогликолевой среды, которые термостатируют при тех же температурах в течение 7 суток. Пробирки, из которых проведен пересев, сохраняют до окончания контроля стерильности. Общий период инкубации — 14 суток.
Стерильность растворителя для сухих препаратов проверяют путем посева по 1 мл в две пробирки с тиогликолевой средой.
Если во время посева используют несколько бутылок растворителя, стерильность каждого проверяют аналогичным способом.
Если объем содержимого одной единицы продукции превышает 100 мл, целесообразно использовать метод мембранной фильтрации.
3.5 Учет и интерпретация результатов исследования на стерильность
Посевы просматривают ежедневно. При отсутствии роста микроорганизмов в питательных средах считают, что образцы соответствуют требованиям стерильности.
Наличие роста микроорганизмов в питательных средах оценивают визуально макроскопически (муть, пленка, осадок, включение) и микроскопически. Отмечают температуру, при которой произошел рост, морфологию клеток и окраску по Граму.
В случае выявления роста даже в одной пробирке проводят повторный контроль удвоенного количества образцов данной серии. В случае прорасту среды хотя бы в одной пробирке при повторном контроле препарат считают нестерильным.
Разрешается до получения заключения о стерильности образца использовать консервированную кровь, эритроцитную массу, эритроцитную взвесь, нативную плазму, нативную свежезамороженную плазму, в том числе и иммунную, в течение 3 суток с момента их заготовки, если во время ежедневного бактериологического контроля исследуемые образцы были стерильными , а условия их заготовки отвечали требованиям в течение предыдущих 3 мес работы.
Результаты всех видов контроля стерильности и условий работы регистрируют в журналах, пронумерованных, прошнурованных, скрепленных печатью и заверенных руководителем.
Во время проведения исследований персонал бактериологической лаборатории обязан соблюдать правила техники безопасности.
РЕЦЕПТЫ ПИТАТЕЛЬНЫХ СРЕД ДЛЯ БАКТЕРИОЛОГИЧЕСКОГО КОНТРОЛЯ
| Питательная среда для контроля стерильности (тиогликолевая) | |
| Панкреатический гидролизат казеина | — 15 г/л |
| Дрожжевой экстракт | — 5 г/л |
| Натрия хлорид | — 2,5 г/л |
| Глюкоза | — 5 г/л |
| Цистин (цистеин) | — 0,75 г/л |
| Тиогликолевая кислота | — 0,3 г/л |
| или натрия тиогликолят | — 0,5 г/л |
| Раствор натрия резазурина1: 1000 свежеприготовленного (можно без натрия резазурина) | 1 г/л |
| Агар микробиологический | — 0,75 г/л |
| Вода дистиллированная | — до 1000 мл |
| pH после стерилизации | — 7,0 ± 0,2 |
| Среда Сабуро (редкая) | |
| Пептон ферментативный | 10 г/л |
| Глюкоза | — 40 г/л |
| Вода дистиллированная | — до 1000 мл |
| pH после стерилизации | — 5,5 ± 0,2 |
| Мясопептонный бульон | |
| Пептон ферментативный | 10 г/л |
| Натрия хлорид | — 5 г/л |
| Мясная вода | — до 1000 мл |
| pH после стерилизации | — 7,3 ± 0,2 |
[doc] Инструкция 1 к Приказу № 012.1-244
[doc] Инструкция 2 к Приказу № 012.1-244
[doc] Инструкция 3 к Приказу № 012.1-244
[doc] Инструкция 4 к Приказу № 012.1-244
Нет связей.
